از نظر FDA، حالات مختلفی وجود دارد تا یک دارو، بهعنوان دارویی جدید شناخته شود؛ مثلا اگر مولکولی داشته باشیم که تا به حال تجاریسازی نشده باشد یا حتی اگر تغییری در فرمولاسیون یک دارو ایجاد کنیم، از نظر FDA منجر به تولید داروی جدید میشود. برای ورود این داروها به مارکت، مسیری طولانی و سخت اما کاملا مشخص و سیستماتیک تعریف شدهاست تا تأییدیه FDA را دریافت کنند.

گام اول
اولین گام، پروسه کشف و توسعه دارو است. در این فرآیند یک دارو از منابع مختلف سنتزی، طبیعی و یا بیولوژیکی بهدست میآید. در گام بعدی، مطالعات پیشبالینی صورت میگیرد تا اثرات درمانی و سمیت دارو اندازهگیری شود. همچنین در این گام مطالعات پیشفرمولاسیون صورت میگیرد تا فرمولاسیون از مقیاس آزمایشگاهی به مقیاس نیمهصنعتی رفته و فرمولاسیون مناسب برای تجویز به انسان بهدست آید. این مراحل حدود 7-6 سال طول میکشد.
پیش از شروع مطالعات بالینی، پروندهای تحت عنوان investigational new drug application (IND) تحویل FDA میگردد. IND توسط FDA بررسی میشود تا اطمینان حاصل شود که آزمایشهای بالینی برای انسان بیخطر خواهد بود. مطالعات داروها بر روی انسانها تنها پس از بررسی IND توسط FDA و نهادی تحت عنوان IRB میتواند آغاز شود. این نهاد، هیئتی متشکل از دانشمندان در بیمارستانها و مؤسسات تحقیقاتی است که بر تحقیقات بالینی نظارت میکنند. هنگامی که یک شرکت، دارویی را توسعه میدهد، چندین سال تحت آزمایشهای مختلف در آزمایشگاه قرار میگیرد تا اینکه یک پرونده IND به FDA برای شروع آزمایش دارو بر روی انسان ارائه شود. از هر 1000 ترکیبی که وارد آزمایشات آزمایشگاهی میشوند، تنها 1 مورد به آزمایش انسانی میرسد.
چطور یک دارو برای تولید یا واردات انتخاب کنیم؟| دوره تحقیقات بازار دارویی
گام دوم
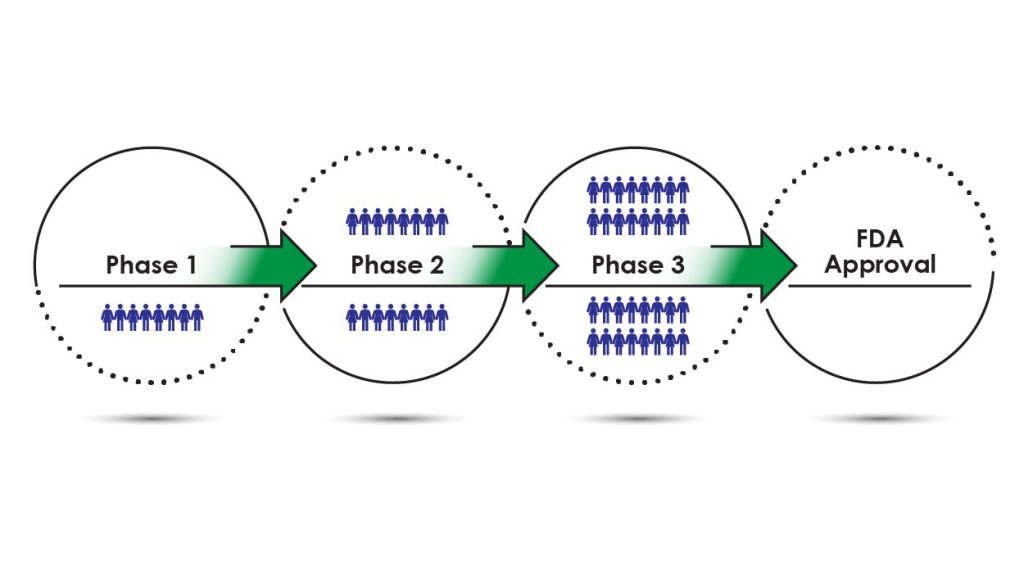
در گام بعدی، مطالعات بالینی آغاز میشود. این مطالعات که بر روی انسانها انجام میگردد، از چهار فاز تشکیل شدهاست. در فاز اول که بر ایمنی و سلامت دارو متمرکز است، دارو به 80-20 داوطلب سالم تجویز میگردد. این فرآیند حدود 1 سال به طول میانجامد. فاز دوم با هدف بررسی کارآیی دارو انجام میگردد. در این فاز حدود 300-100 بیمار داوطلب با دارو مواجه میشوند تا بازدهی دارو مورد بررسی قرار گیرد. همچنین در این مرحله دستههایی از بیماران با دارونماها (placebo) مواجه میگردند تا نتیجه بازدهی دارو شکل واقعیتری به خود بگیرد. این فاز حدود 2 سال طول میکشد.
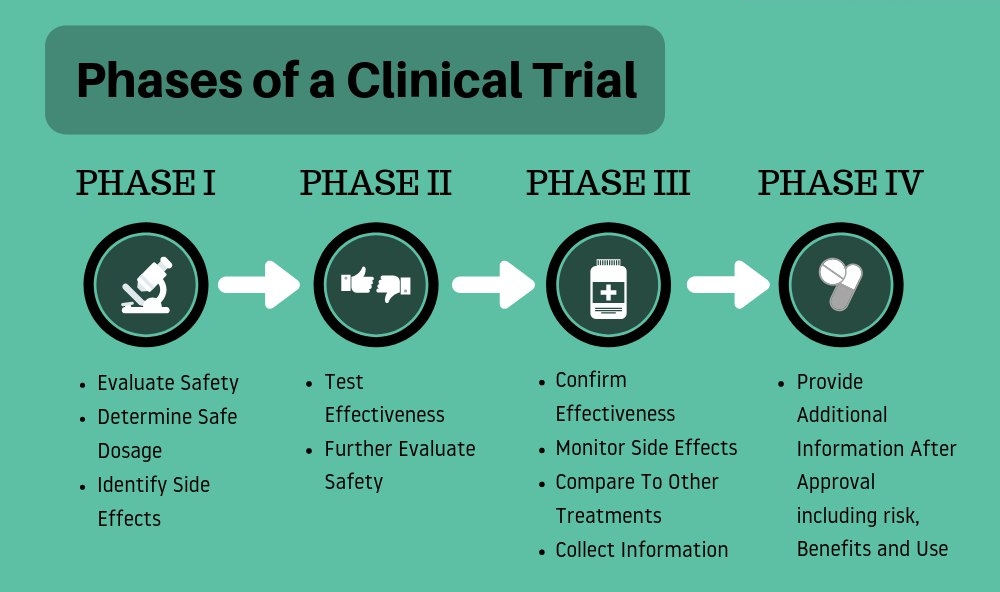
اگر کارآیی دارو در فاز دوم تایید شود، فاز سوم آغاز میگردد. در این فاز تا 3000 بیمار مورد کنترل قرار میگیرند تا بازدهی دارو و همچنین عوارض آن مورد بررسی قرار گیرد. در این فاز، بیماران با محدوده سنی متفاوت مورد ارزیابی قرار میگیرند. دوزهای مختلف دارو نیز در این مرحله بررسی میشود. این فاز حدودا 3 سال به طول میانجامد.

حال اگر دارو این فازهای بالینی مطرح شده را با موفقیت پشت سر گذاشت، شرکت بالینی با ارائه پرونده جدیدی به FDA تحت عنوان new drug application (NDA)، منتظر تایید نهایی دارو میماند. برای NDA، شرکت درخواستی را مینویسد که شامل هزاران صفحه است و برای بررسی و تایید، به FDA ارائه میکند. NDA شامل تمام دادههای حیوانی و انسانی، به علاوه عوارض جانبی، دوز و اثربخشی است. اطلاعات دیگری مانند فارماکوکینتیک (نحوه حرکت دارو در بدن) و مشخصات ساخت نیز مورد توجه قرار گرفتهاست. تیم FDA شصت روز فرصت دارد تا NDA را بررسی کند و تعیین کند که آیا بررسی بیشتر لازم است یا خیر.
همچنین بخوانید: آشنایی با دپارتمان تولید دارو در شرکت داروسازی
پس از تأیید دارو، فاز چهارم مطالعات بالینی اتفاق میافتد. مطالعات فاز چهارم اطلاعات بیشتری در مورد ایمنی، کارآیی یا استفاده بهینه محصول پس از تأیید جمعآوری میکند. مطالعات Post marketing ممکن است در گروههایی از بیمارانی که از دارو در زندگی روزمره استفاده میکنند، انجام شود.
تأییدیه FDA
سالانه حدود 40-30 تركيب جديد براى ورود به بازار تأییدیه FDA میگيرند. اين تعداد حتی با وجود پیشرفتهایی كه در حوزههاى مختلف از جمله مطالعات آزمايشگاهی صورت میگیرد، تغييرى نمیكند و اگر سالهاى مختلف را مقايسه كنيم حتی ممكن است این تعداد كم شده باشد و اين مسئله به خاطر اين است كه داروهاى موجود در بازار پاسخگوى بيماریهاى مختلف هستند و داروى جديد بايد ويژگی منحصر به فردى داشته باشد تا مجوز بگيرد.
سخن پایانی
در این مطلب به بررسی فرآیند ورود یک دارو به بازار پرداختیم که از کشف و توسعه دارو شروع و با مطالعات بالینی و پیشبالینی ادامه پیدا میکرد و در نهایت با تأیید FDA، دارو روانه بازار میشد. پروسه مذکور حدودا 15 سال به طول میانجامد و هزینه هنگفتی برای تیم تولیدکننده به همراه دارد؛ احتمال شکست بالاست و ضمناً تنها 30% از داروهای تولیدشده، هزینه تولید را به شرکت تولیدکننده برمیگردانند که این خود نشاندهنده دشواری بسیار این فرآیند است.


